| |
......การเปลี่ยนแปลงใดก็ตามที่ได้สารใหม่เกิดขึ้น
(สมบัติของสารตั้งต้นและผลิตภัณฑ์ต่างกัน) ถือว่าการเปลี่ยนแปลงนั้น
เกิดปฎิกริยาเคมี ซึ่งเมื่อมีปฎิกริยาเคมีเกิดขึ้น จะมีพลังงานเข้ามาเกี่ยวข้องด้วยเสมอ
ซึ่งมี 2 ประเภทเช่นกัน
|
1.ปฎิกริยาเคมีแบบดูดความร้อน
|
ปฎิกริยาแบบนี้จะทำให้ระบบมีพลังงานสูงขึ้น
สังเกตจาก
สมการจะมีลักษณะดังนี้
สารตั้งต้น + พลังงาน  สารผลิตภัณฑ์
สารผลิตภัณฑ์
เช่น A + 100kJ  B หรือ A
B หรือ A  B B
 H
= +100 kJ H
= +100 kJ
หรือจะได้กราฟ
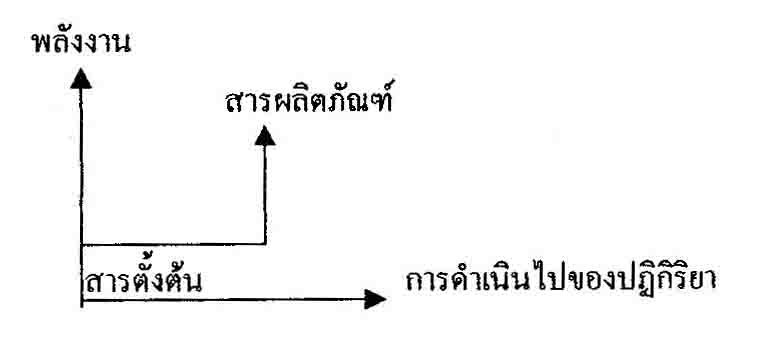
คือ หลังเกิดปฎิกริยา พลังงานจะต้องเพิ่มขึ้น
|
2.ปฎิกริยาเคมีแบบคายความร้อน
|
ปฎิกริยาแบบนี้จะทำให้ระบบมีพลังงานต่ำลง
สังเกตจาก
สมการจะมีลักษณะดังนี้
สารตั้งต้น 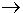 สารผลิตภัณฑ์ + พลังงาน
สารผลิตภัณฑ์ + พลังงาน
เช่น D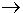 E+ 100kJ หรือ D
E+ 100kJ หรือ D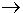 E E
 H
= -100 kJ H
= -100 kJ
หรือจะได้กราฟ
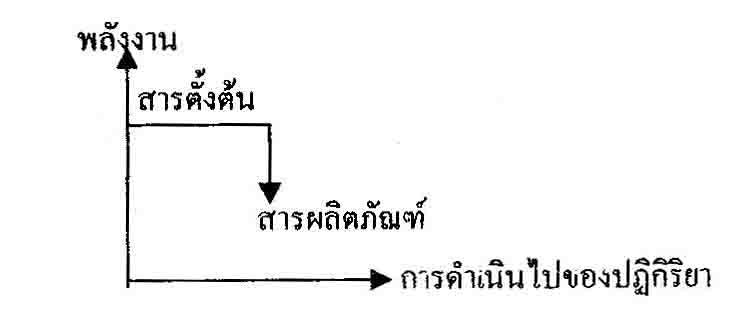
คือ หลังเกิดปฎิกริยา พลังงานจะต้องต่ำลง
|
ตัวอย่าง
:
|
จากกราฟเป็นการเกิดปฎิกริยาชนิดใด
และมีการเปลี่ยนแปลงพลังงานเท่าไร
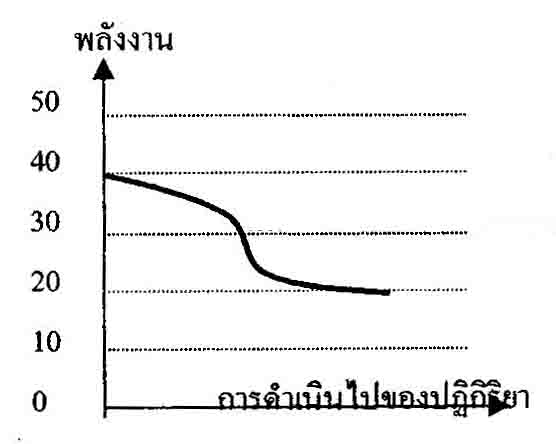
|
...เราจะได้ว่า เริ่มแรกสารมีพลังงาน
40kJ และเมื่อปฎิกริยาดำเนินไปสารเหลือพลังงานแค่ 20kJ กราฟมีลักษณะต่ำลง
จึงเป็นการเปลี่ยนแปลงแบบคายพลังงาน = 40-20 = 20 kJ
|