| |
......การละลายก็เกี่ยวข้องกับการเปลี่ยนแปลงพลังงานเช่นกัน
ดังนั้นการละลายจึงมีได้ 2 ประเภท คือ การละลายแบบดูดความร้อน และการละลายแบบคายความร้อน
|
ขั้นตอนการละลายน้ำ
|
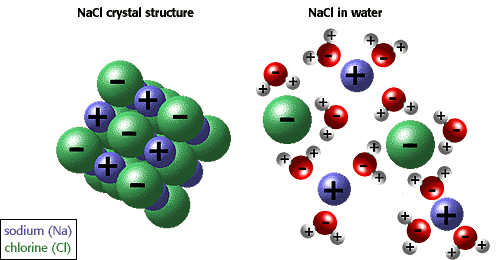
......ถ้าสมมติเรานำเกลือแกง(NaCl)
ไปละลายน้ำ จะมีขั้นตอนที่เกี่ยวข้อง ดังนี้
|
|
|
| |
1. ทำให้อนุภาคของของแข็งแยกออกจากกัน เป็นการทำลายแรงยึดเหนี่ยวระหว่างอนุภาค
ขั้นตอนนี้ต้องใช้พลังงานซึ่งมีค่าเท่ากับพลังงานโครงร่างผลึก(พลังงานโครงร่างผลึก
Lattice energy คือ พลังงานที่ใช้แยกอนุภาคของของแข็งออกจากกันในภาวะก๊าซ)
จะได้
NaCl(s)
+ พลังงานโครงร่างผลึก 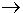 Na+(g) + Cl-(g)
: ดูดพลังงาน
Na+(g) + Cl-(g)
: ดูดพลังงาน  H1 H1
>
ขั้นตอนนี้เป็นการดูดพลังงานเพื่อสลายพันธะเดิมของ NaCl
|
2. อนุภาคที่ถูกแยกออกมาจากขั้นตอนแรกจะไปจับกับอนุภาคของน้ำดังรูปด้านบน
อนุภาคของน้ำจะคายพลังงานออกมาจำนวนหนึ่ง เรียกว่า พลังงานไฮเดรชัน
(Hydration energy)
Na+(g) + Cl-(g)
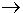 Na+(aq) + Cl-(aq) :
คายพลังงาน
Na+(aq) + Cl-(aq) :
คายพลังงาน  H2 H2
>
ขั้นตอนนี้เป็นการคายพลังงานเพื่อสร้างพันธะกับน้ำ โดย aq มาจาก aqueous
หมายถึง สารละลายที่มีน้ำเป็นตัวทำละลาย
|
ถ้าเรารวมขั้นตอนทั้ง 2 เข้าด้วยกันจะได้
NaCl(s)
+ พลังงานโครงร่างผลึก 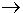 Na+(aq) + Cl-(aq)
:
Na+(aq) + Cl-(aq)
:  H3 H3
โดย :  H3
= H3
=  H1
- H1
-  H2 H2
ถ้า  H3
เป็นค่าบวกแสดงว่าดูดความร้อน H3
เป็นค่าบวกแสดงว่าดูดความร้อน
ถ้า  H3
เป็นค่าลบแสดงว่าคายความร้อน H3
เป็นค่าลบแสดงว่าคายความร้อน
ถ้า  H3
= แสดงว่าไม่ดูดไม่คายความร้อน H3
= แสดงว่าไม่ดูดไม่คายความร้อน
|
สรุป :
|
...เพราะฉะนั้นในการละลายครั้งหนึ่งจะมีทั้งการดูดและการคายพลังงาน
โดยถ้า
พลังงานโครงร่างผลึก > พลังงานไฮเดรชั่น
: จะเป็นการละลายแบบดูดความร้อน
พลังงานไฮเดรชัน > พลังงานโครงร่างผลึก : จะเป็นการละลายแบบคายความความร้อน
แต่ถ้า!
พลังงานโครงร่างผลึก >>>
พลังงานไฮเดรชั่น
...คือถ้าพลังงานโครงร่างผลึกมากว่าพลังงานไฮเดรชั่นมากๆ สารนั้นจะไม่ละลายน้ำ
|
|
การคำนวณการละลาย
|
ใช้สูตร
Q
= mc( t) t)
Q
= ปริมาณความร้อน
m =มวลของน้ำ
s = ความจุความร้อน (= 1cal/g หรือ 4.2 J/g หรือ 4.2 kj/kg)
 t
= อุณหภูมิที่เปลี่ยนแปลง t
= อุณหภูมิที่เปลี่ยนแปลง
|
ตัวอย่าง :
เมื่อนำสาร AB จำนวน 10 กรัมมาละลายในน้ำ 100 g อุณหภูมิก่อนละลาย 23๐C
อุณหภูมิหลังละลาย 30๐C จงหาปริมาณความร้อนที่เกิดขึ้นเป็นจูล
|
วิธีคิด :
จาก
Q = mc( t)
จะได้ t)
จะได้
Q = 100 x 4.2 x (30-23) =
2,940 จูล
(จะเห็นได้ว่าเราไม่ต้องคำนึงถึงปริมาณสาร AB เลย
และหลังละลายน้ำมีอุณหภูมิสูงขึ้นแสดงว่าเป็นการละลายแบบคายความร้อน)
|